MICROSCOPIA Y CULTIVO IN VITRO
En 1676 Antonvan Leeuwenhoek quien uso los primeros microscopios observando bacterias en agua. En 1881 Hesse utilizó aga permitiendole cultivas colonias macroscópicas a lo largo se volvio a usar la cocina hoy usado como la microbiologia clinica. En la actualidad sigue usandose el microscopio para identificar la causa de infecciones.
Utiliza la microbiología para la detección inicial, identificación preliminar o definitivas de los microorganismos,La microscopia se utiliza para muestras clinicas ya sea viricas, fungicas, parásitos, células bacterianas y en general a células infectadas; los métodos de microscopio ah sido muy útil para su identificación mejor.
TIPOS DE MICROSCOPIO
🔬 MICROSCOPIO DE CAMPO CLARO(ÓPTICA): Es en donde se usa la luz para iluminar la muestra para ampliar la imagen se usa el objetivo y los oculares. En este tipo de microscopio utiliza transiluminación, se utilizan tres lentes de objetivos diferentes, 10 veces, 40 veces y de 100 veces. La capacidad maxima de luz es el aceite de inmersión, la capacidad maxima tiene hasta 0,2 um. Los indices de refracción de los microorganismos y el fondo son similares.
🔬 MICROSCOPIO DE CAMPO OSCURO: Tambien se utilizan para objetivos y oculares, a diferencia de que este usa el condensador que impide a la luz transmitir directamente a la muestra, la capacidad de resolución es mayor que la del microscopio de campo claro. La desventaja que tiene es que no atraviesa al microorganismo y es mas complejo para estudiarlo.
🔬 MICROSCOPIO DE CONTRASTE DE FASES: Permite examinar los detalles internos del microorganismo, se hacen pasar haces de luz paralela a través de objetos de densidad diferente es decir cuanto aun mas denso atraviesa mejor el haz de luz, mediante anillos anulares. Se amplifican con la ayuda de luz y eso crea una imagen tridimensional y permite el analisis detallado de estructuras internas.
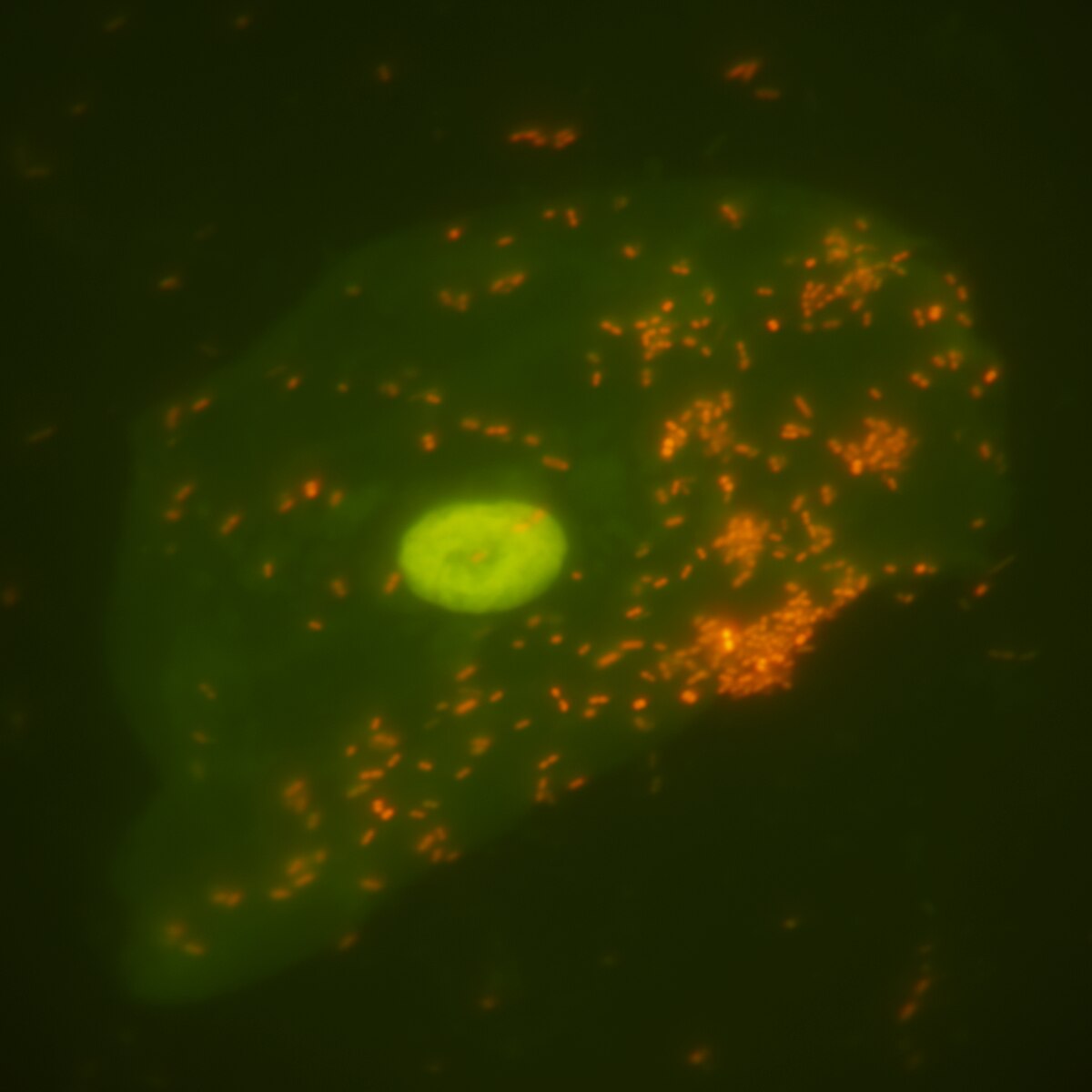
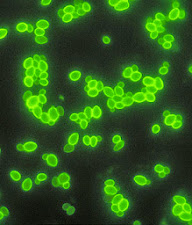
🔬 MICROSCOPIO FLUORESCENTE: Los fluorocromos que absorben la luz ultravioleta o ultraluz emitiendo una onda visible y mayor, aunque algunos son autofluorecentes. Su tinción es con colorantes fluorescentes, los microorganismos teñidos con el fluorocromo tiene un fondo oscuro ; esta depende del fluorocromo seleccionado, tomar en cuenta que no es necesario el aumento mayor ya que se puede realizar una búsqueda rápida con un aumento bajo.
🔬 MICROSCOPIO ELECTRÓNICO: Se utilizan bobinas magneticas para dirigir un haz de electrones desde un filamento de tungsteno de una muestra hacia una pantalla, en este caso la resolución y la amplificación mejora ampliamente, con esta de observa particulas víricas. Hay 2 tipos de microscopio electrónico.
- Microscopio electrónico de transmisión: Los electrones atraviesan la muestra
- Microscopio electrónico de barrido: Los electrones rebotan en la superficie de la muestra generando una imagen tridimensional.
PARTES DEL MICROSCOPIO
🔎 PARTE MECÁNICA:
- La Platina
- El carro
- El pie o base
- El brazo
- El tornillo macrometrico y micrometrico
- El cabezal
- El revolver
- Pinzas de sujeción
- El tubo
🔎 PARTE ÓPTICA:
- Los oculares
- El condensador
- El diafragma que regula la luz hacia la muestra
- Los objetivos
- Foco o fuente de luz
MÉTODOS DE ESTUDIO:
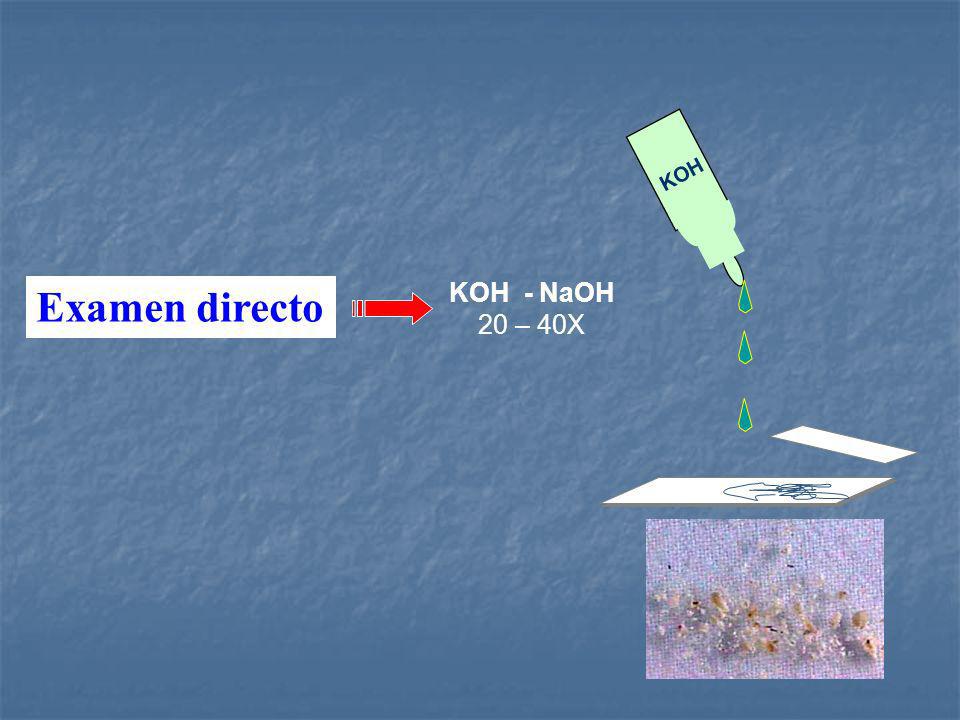
🎨 ESTUDIO DIRECTO:
Preparación en fresco: La preparación no teñida se estudia mediante microscopia de campo claro, campo oscuro o de contraste de fases.
KOH al 10%: Se utiliza KOH para disolver el material proteináceo y facilitar la detección de elementos fúngicos que no se ven afectados por la solución alcalina fuerte. Se pueden añadir colorantes como azul de algodón lactofenol para aumentar el contraste entre los elementos fúngicos y el fondo.
Tinta china: Modificación del procedimiento de KOH en el que se añade tinta china como material de contraste. El colorante se utiliza principalmente para detectar el género Cryptococcus en el líquido cefalorraquídeo y en otros líquidos corporales.
Yodo de Lugol: Se añade yodo a preparaciones en fresco de muestras de parasitología para mejorar el contraste de las estructuras internas lo que facilita la diferenciación entre las amebas y los leucocitos del huésped.
🎨 TINCIONES DIFERENCIALES:
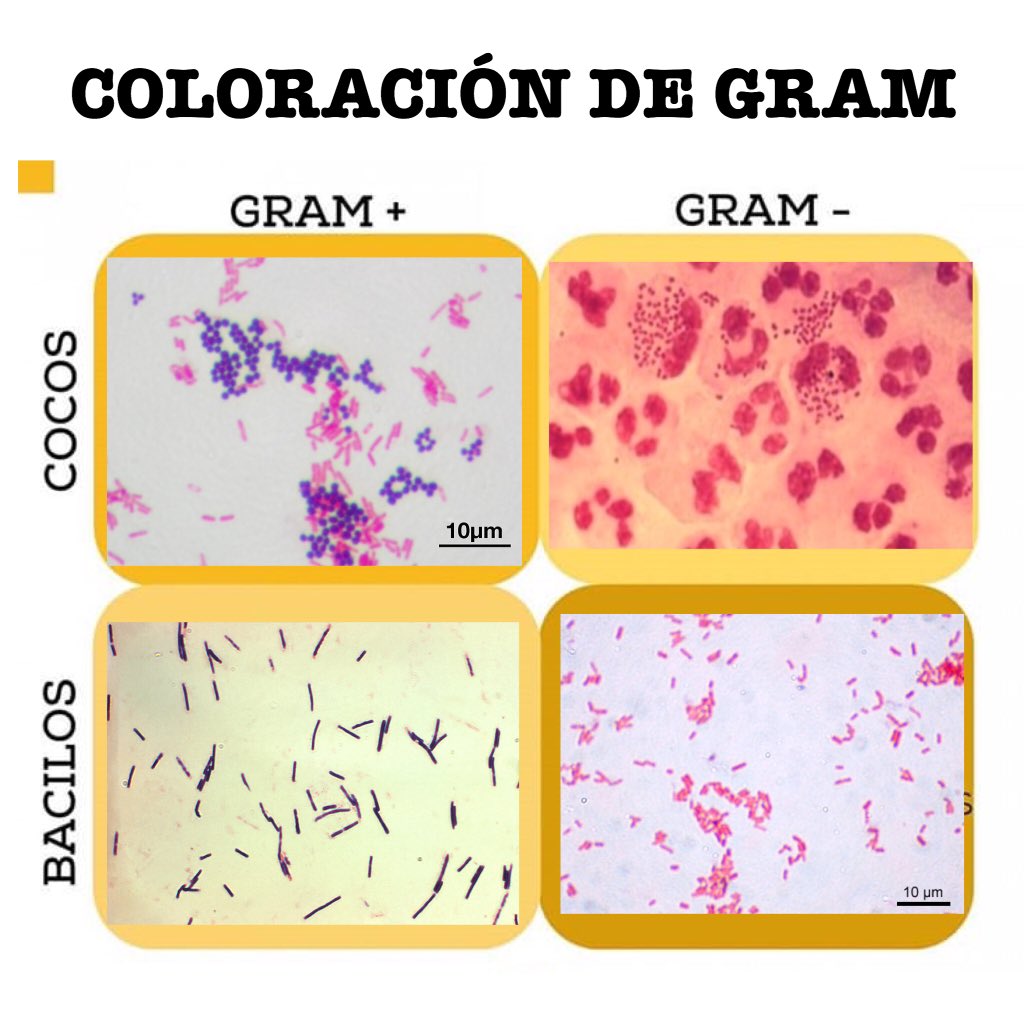
Tinción de Gram: Mas utilizada en el laboratorio de microbiología, constituye la base para separar los principales grupos de bacterias como las grampositivas(violeta por su pared gruesa) y gramnegativas(rosado con pered delgada). Después de la fijación de la muestra a un portaobjetos de vidrio con alcohol, se expone la muestra a violeta de cristal y después se añade yodo para formar el complejo con el colorante principal. Durante la descoloración con alcohol o acetona el complejo queda retenido en las bacterias grampositivas, aunque se pierde en los microorganismos gramnegativos; los microorganismos gramnegativos retienen el colorante safranina(rojo).
Tinción de hematoxilina férrica: Se utiliza para la detección e identificación de protozoos fecales. Los huevos y las larvas de helmintos retienen demasiado colorante, por lo que se identifican con más facilidad en preparaciones en fresco.
Metenamina de plata: Generalmente utilizado en laboratorios de histología, no de microbiología. Se utiliza principalmente para la detección tintorial de elementos fúngicos en los tejidos, también se pueden detectar otros microorganismos, como bacterias. También precisa habilidad, porque la tinción inespecífica puede hacer que no se puedan interpretar los portaobjetos.
Tinción de azul de toluidina O: Utiliza principalmente para la detección de microorganismos del género Pneumocystis en muestras respiratorias. Los quistes se tiñen de color rojo-azul a morado oscuro sobre un fondo de color azul claro. La tinción del fondo se elimina con un reactivo de sulfatación. Muchos laboratorios han sustituido esta tinción por tinciones fluorescentes específicas.Los trofozoítos no se tiñen.
Tinción tricrómica: Alternativa a la hematoxilina férrica para teñir protozoos. Los protozoos tienen citoplasmas de color azulado-verde a morado con núcleos rojos o morados-rojos y cuerpos de inclusión; el fondo de la muestra es verde.
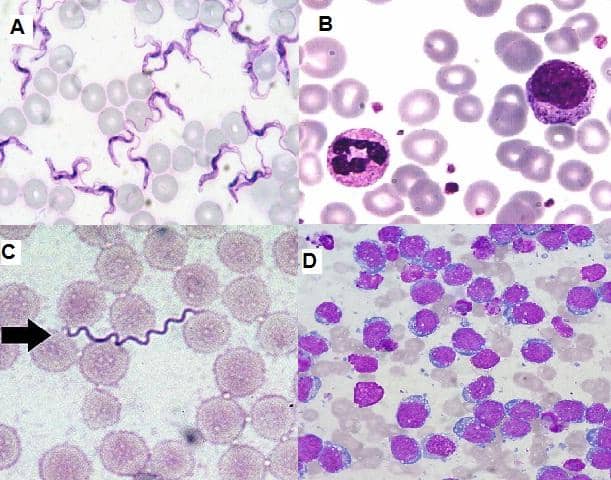
Tinción de Wright-Giemsa: Se utiliza para detectar parásitos sanguíneos, cuerpos de inclusión víricos y por clamidias. Se trata de una tinción policromática que contiene una mezcla de azul de metileno, azur B y eosina Y. La tinción de Giemsa combina azul de metileno y eosina. Los iones de eosina tienen carga negativa y tiñen componentes básicos de las células, de naranja a rosa, mientras que otros colorantes tiñen las estructuras ácidas de la célula con diversos tonos de azul a morado.
🎨 TINCIONES ACIDORRESISTENTES:
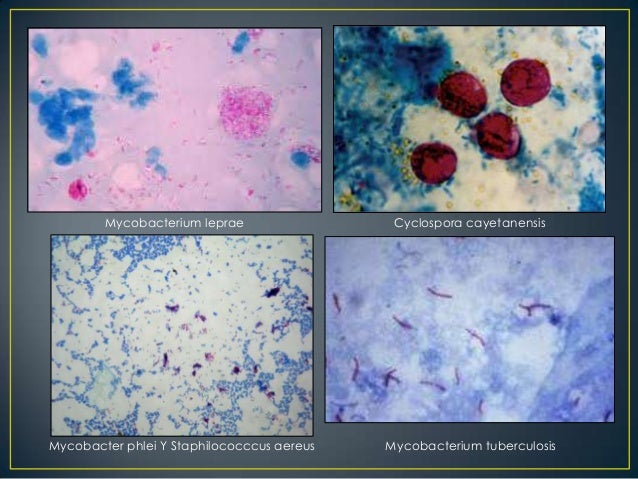
Tinción de Ziehl-Neelsen: Son para teñir micobacterias y otros microorganismos acidorresistentes. Los microorganismos se tiñen con carbolfucsina básica y resisten a la descoloración con soluciones de ácido-alcohol. Se realiza contratinción del fondo con azul de metileno. Los microorganismos aparecen de color rojo sobre un fondo azul claro. La captación de carbolfucsina precisa el calentamiento de la muestra, tinción acidorresistente caliente.
Tinción de Kinyoun: Tinción acidorresistente en frío (no precisa calentamiento). Mismo principio que la tinción de Ziehl-Neelsen.
Auramina-rodamina: Mismo principio que otras tinciones acidorresistentes, excepto que se utilizan colorantes fluorescentes como la auramina y rodamina (tinción principal), y el permanganato potásico (oxidante fuerte) actúa como contratinción e inactiva los colorantes de fluorocromo no unidos. Los microorganismos tienen fluorescencia amarillenta-verde sobre un fondo negro.
Tinción acidorresistente modificada: Se utiliza un decolorante débil con cualquiera de las tres tinciones acidorresistentes mencionadas. Micobacterias son muy acidorresistentes, otros microorganismos más débilmente se tiñen (p. ej., Nocardia, Rhodococcus, Tsukamurella, Gordonia, Cryptosporidium, Isospora, Sarcocystis y Cyclospora). Estos microorganismos se pueden teñir con más eficiencia usando un decolorante débil denominados acidorresistente.
🎨 TINCIONES FLUORESCENTES:
Tinción de naranja de acridina: Se utiliza para detectar bacterias y hongos en muestras clínicas. El colorante se intercala en el ácido nucleico natural y desnaturalizado. A pH neutro las bacterias, los hongos y el material celular se tiñen de color rojizo-naranja. A pH ácido de las bacterias y los hongos siguen siendo de color rojizo-naranja, aunque el material de fondo se tiñe de color verdoso-amarillo.
Tinción de auramina-rodamina: Igual que las tinciones acidorresistentes.
Tinción de blanco de calcoflúor: Se utiliza para detectar elementos fúngicos y el género Pneumocystis. El colorante se une a la celulosa y la quitina de las paredes celulares; el microscopista puede mezclar el colorante con KOH muchos laboratorios cambiaron el colorante de KOH.
Tinción directa con anticuerpos fluorescentes: Los anticuerpos mono o policlonales forman complejos con moléculas fluorescentes. La unión específica a un microorganismo se detecta por la presencia de fluorescencia del microorganismo. La técnica ha sido útil para detectar muchos microorganismos como Pneumocystis, Cryptosporidium, Giardia, virus gripal, virus del herpes simple, etc. La sensibilidad y la especificidad de la prueba dependen del número de microorganismos presentes en la muestra que se va a estudiar y la calidad de los anticuerpos utilizados en los reactivos.
CULTIVO IN VITRO
Depende de la biologia del microorganismo, del lugar de infección, respuesta inmunitaria del paciente frente a medios de cultivo como legionella (de hierro y L-cisteína), campylobacter (patogeno estérico), entre otros. Se han desarrollado muchos medios de cultivo que permiten suprimir estos germenes existentes en condiciones normales y facilitan la detección. La inmunidad innata y adaptativa del paciente pueden suprimir el patógeno, algunas infecciones se caracterizan por la existencia de relativamente pocos germenes, se debe controlar con cuidado la calidad de los medios de cultivo para garantizar que su rendimiento se corresponde con el exigido.
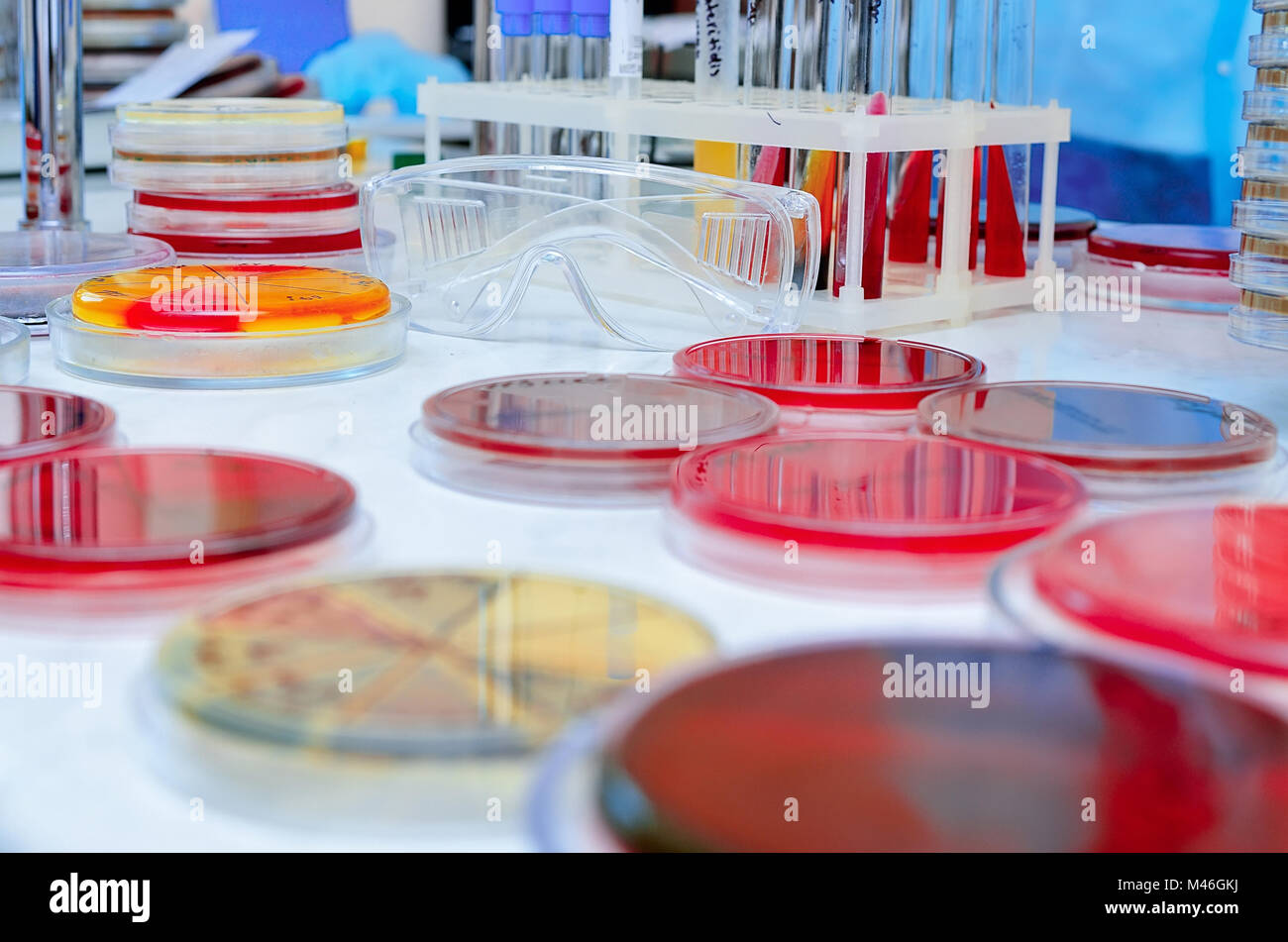
TIPOS DE MEDIOS DE CULTIVO
💉 MEDIOS DE CULTIVO NO SELECTIVOS ENRIQUECIDOS:
Agar sangre: Los laboratorios clínicos utilizan muchos tipos de cultivo agar sangre. Los medios contienen dos componentes fundamentales: un medio basal (soja tripticasa, infusión de cerebro-corazón, base de Brucella) y sangre (de oveja, caballo, conejo), se pueden añadir varios suplementos más.
Agar chocolate: Es un agar modificado, cuando se añade sangre o hemoglobina al medio de base calentado, se vuelve marrón. Este medio permite el crecimiento de la mayor parte de las bacterias, incluidas algunas que no crecen en el agar sangre.
Agar Mueller-Hinton: Es un medio recomendado para estudios convencionales de sensibilidad bacteriana. Su composición está bien definida e incluye extractos de ternera y caseína, sales, cationes divalentes y almidón soluble necesario para que los resultados sean reproducibles.
Caldo tioglicolato: Trata de uno de los medios de cultivo de enriquecimiento empleados para recuperar cantidades pequeñas de bacterias aerobias y anaerobias, la mayor parte incluyen caseína, glucosa, extracto de levadura, cisteína y tioglicolato sódico. El suplemento de hemina y vitamina K mejora la recuperación de las bacterias anaerobias.
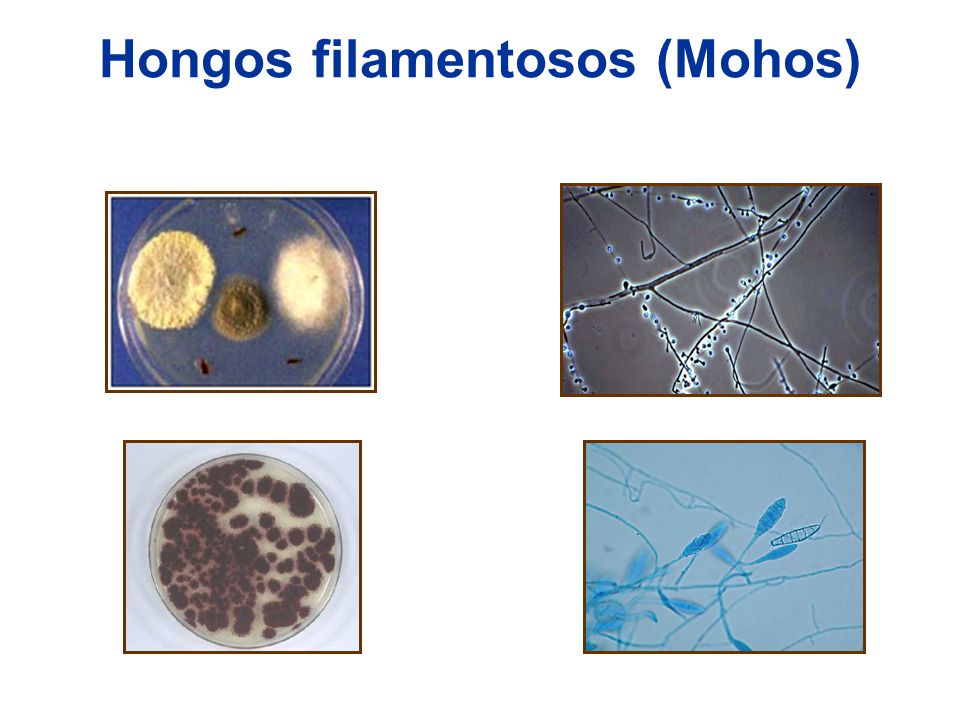
Agar dextrosa de Sabouraud: Un medio de cultivo enriquecido que contiene caseína y tejido animal digeridos suplementados con glucosa que se emplea para aislar hongos, Los micólogos utilizan la que tiene baja concentración de glucosa y un pH neutro, al reducir el pH y añadir antibióticos para inhibir las bacterias, puede ser selectivo de hongos.
💉 MEDIOS DE CULTIVO SELECTIVOS Y DIFERENCIALES:
Agar MacConkey: Agar selectivo para las bacterias gramnegativas y diferencial para distinguir las bacterias que fermentan la lactosa y las que no, incluye peptonas digeridas, sales biliares, lactosa, rojo neutro y cristal violeta. Las sales biliares y el cristal violeta inhiben las bacterias grampositivas.
Agar sal manitol: Medio de cultivo selectivo empleado para el aislamiento de estafilococos, el medio incluye extractos de caseína y tejidos animales digeridos, extracto de ternera, manitol, sales y rojo fenol.
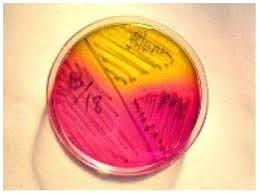
Agar xilosa-lisina-desoxicolato (XLD): Se trata de un agar selectivo utilizado en la detección de Salmonella y Shigella en cultivos entéricos. Es un ejemplo de un abordaje muy inteligente para la detección de bacterias importantes en una mezcla compleja de bacterias insignificantes. El medio corresponde a un extracto de levaduras con xilosa, lisina, lactosa, sacarosa, desoxicolato sódico, tiosulfato sódico, citrato amónico férrico y rojo fenol. El desoxicolato sódico inhibe el crecimiento de la mayor parte de las bacterias no patógenas. Se añade verde malaquita para inhibir las bacterias grampositivas.
Agar Middlebrook: Este medio de cultivo de agar se emplea también para aislar micobacterias. Contiene nutrientes necesarios para su crecimiento y verde malaquita para inhibir las bacterias grampositivas, se solidifica con agar.
CHROMagar: Es un agar selectivo diferencial utilizado para aislar e identificar algunas especies distintas de la levadura Candida. Este medio contiene cloranfenicol para inhibir las bacterias. Las distintas especies de Candida cuentan con enzimas que permiten emplear uno o más de los sustratos liberando el compuesto coloreado y generando colonias de colores.
Agar con inhibidor de hongos filamentosos: Compuesto selectivo enriquecido que se emplea para el aislamiento de hongos patógenos distintos de los dermatofitos. Se añade cloranfenicol para suprimir el crecimiento de las bacterias contaminantes.
💉 MEDIOS ESPECIALIZADOS:
Se han creado muchos medios de cultivo especializados distintos para detectar gérmenes específicos, que pueden ser exigentes o que se presentan mezclados con muchos otros.
Los más empleados se describen en los capítulos relativos a cada germen concreto de esta obra.
CULTIVO CELULAR
Algunas bacterias y todos los virus son gérmenes intracelulares estrictos, de forma que sólo se pueden cultivar en células vivas. Los cultivos celulares pueden ser células que crecen y se dividen sobre una superficie o células suspendidas en un medio de cultivo. Algunos cultivos celulares están bien establecidos y se pueden mantener de forma indefinida. Otros cultivos celulares se deben preparar inmediatamente antes de infectarlos con bacterias o virus y no se pueden mantener en el laboratorio más de unos pocos ciclos de división.















Comentarios
Publicar un comentario